- · 《临床药物治疗杂志》编[10/30]
- · 《临床药物治疗杂志》杂[10/30]
- · 《临床药物治疗杂志》杂[10/30]
- · 《临床药物治疗杂志》期[10/30]
- · 《临床药物治疗杂志》数[10/30]
- · 《临床药物治疗杂志》投[10/30]
- · 临床药物治疗杂志版面费[10/30]
中国精神分裂症患者长期药物治疗的安全性及相
作者:网站采编关键词:
摘要:对于精神分裂症患者来说,非典型抗精神病药物是广泛使用的一线用药。然而,它的安全性仍需要在大量人群中进行评估,特别是在中国患者中。 本研究的主要目的是评估中国精神分裂
对于精神分裂症患者来说,非典型抗精神病药物是广泛使用的一线用药。然而,它的安全性仍需要在大量人群中进行评估,特别是在中国患者中。

本研究的主要目的是评估中国精神分裂症患者长期使用非典型抗精神病药物的安全性和相关因素,为临床实践制定优化的药物治疗方案。次要目标包括非典型抗精神病药物在这些患者中的长期疗效,以及药物经济学评估、人群药代动力学研究和药物基因组学研究。
方法
本研究采用观察性设计。上海精神卫生中心伦理委员会审查并批准了该方案。批准号为2010–35。该项目已在国际临床试验注册平台 (www. clinicaltrials. gov NCT0)上注册。
非典型抗精神病药物包括喹硫平、奥氮平、利培酮、阿立哌唑、齐拉西酮、帕利哌酮、氨磺必利、哌罗匹隆和氯氮平。随访时间分别为0、4、8、13、26、52、78、104、130和156周。
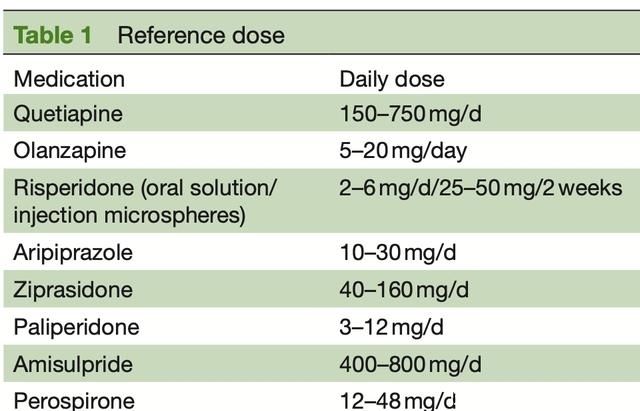
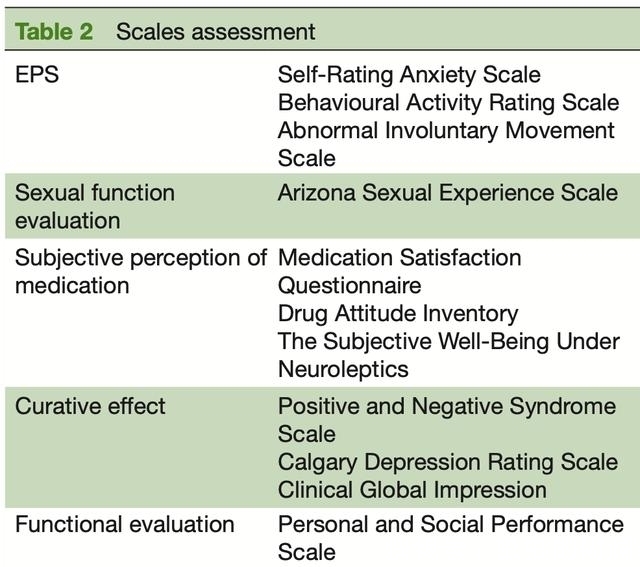
疗效评估包括症状、社会功能、复发率和住院治疗。安全措施包括身体检查、生命体征、腹围、实验室检查(如血细胞分析、血液生化检查、血清催乳素/甲状腺素水平)、12导联心电图、锥体外系综合征评估、性功能评估、药物治疗及其他不良事件。
次要指标包括阳性和阴性综合征量表、临床总体印象-疾病严重程度量表、精神分裂症卡尔加里抑郁量表、个人和社会表现量表、复发率、药物合并、医疗相关费用、收入、药物血药浓度和遗传信息。
研究过程
知情同意书必须由受试者及其监护人签署并注明日期。研究人员应妥善保管每份已签署的知情同意书并存档。考虑到本研究的特殊性,受试者可以自愿选择是否参与人群药代动力学研究、药物基因组学研究或扩展研究。在本研究中,一些研究中心可能尝试使用多媒体知情同意书。多媒体知情同意书的内容应与书面知情同意书的内容一致,并需伦理委员会审核批准。
在本研究中,研究人员将在每个受试者及其家属签署知情同意书后,收集人口统计学数据,详细评估患者的病史、治疗史、家族史、医疗费用和社会支持情况。此外,研究人员还将收集数受试者的吸烟和饮酒状况,抗精神病药物的使用,共病的疾病和症状,联合用药和身体体检结果(包括生命体征和腹围),完整的实验室检查结果(包括常规血液检查、肝脏和肾脏功能、电解质和血脂)和心电图检查。如果患者是育龄妇女,如果研究人员认为有必要,可以进行尿液妊娠试验。
完成基线评估后,将预约与患者的第二次就诊(4周后)。在第2至第8次随访期间(基线后4、8、13、26、52、78、104、130和156周),研究人员将识别出类似的情况并进行相同的量表评估。在最后一次随访(第10次)时,将要求患者填写研究完成表,并询问患者是否愿意参加长期随访研究。如果患者未能按照计划完成10次随访,则将按照第10次随访的内容进行研究结束前的最后一次随访(表3)。
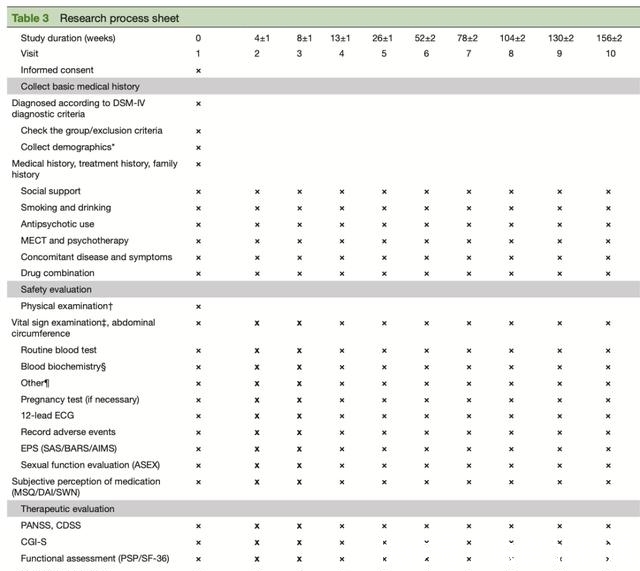
在研究过程中,患者有责任报告身体或心理状况的任何变化。本研究收集的所有信息将由训练有素的调查人员进行综合评估,然后输入统一的电子数据采集系统。另外,需要向受试者提供研究人员的联系方式,以便受试者可以随时与研究人员联系。研究人员应询问受试者的联系方式,以便及时与受试者取得联系。此外,研究人员应在每次预期随访前提醒受试者到访时间,并督促受试者完成实验室测试。
讨论
现实世界的研究证据更有利于指导临床实践。尽管随机对照研究非常有效,但病例数量有限,随访时间短,患者选择可能缺乏典型性。鉴于明确的纳入或排除标准,被纳入的人群可能无法提供关于现实世界中抗精神病治疗有效性的信息。
本研究是一项大样本、非干预性、长期前瞻性观察研究,旨在真实反映临床实践的具体细节,充分尊重患者的需求,了解患者的治疗意图和实际治疗细节。
总结
本文介绍了本研究的背景、目的、设计和研究流程,并提出了评价非典型抗精神病药物在精神分裂症患者临床治疗中的疗效的方法。
文章来源:《临床药物治疗杂志》 网址: http://www.lcywzlzz.cn/zonghexinwen/2021/0317/699.html