- · 《临床药物治疗杂志》编[10/30]
- · 《临床药物治疗杂志》杂[10/30]
- · 《临床药物治疗杂志》杂[10/30]
- · 《临床药物治疗杂志》期[10/30]
- · 《临床药物治疗杂志》数[10/30]
- · 《临床药物治疗杂志》投[10/30]
- · 临床药物治疗杂志版面费[10/30]
前沿生物抗新冠药物国内获批临床 商业落地或仍
作者:网站采编关键词:
摘要:《科创板日报》(上海,记者 朱洁琰)讯, 在腾盛博药获批国内首个新冠中和抗体药物之后,近日,前沿生物发布公告称,其研发的新冠病毒注射药物FB2001已被国家药监局获批临床。
《科创板日报》(上海,记者 朱洁琰)讯,在腾盛博药获批国内首个新冠中和抗体药物之后,近日,前沿生物发布公告称,其研发的新冠病毒注射药物FB2001已被国家药监局获批临床。
公开资料显示,FB2001为新冠肺炎病毒蛋白酶抑制剂,药物机制与辉瑞旗下口服抗病毒候选药物PAXLOVID类似,不过FB2001是注射剂。
据《科创板日报》记者了解,蛋白酶抑制剂治疗新冠潜力较受业界认可。不过,相比其他国产新冠药物,前沿生物FB2001的研发进展似乎相对缓慢,或影响后期商业落地。
今年4月,FB2001获得美国FDA核准签发的临床试验批件,并在美国启动了药物I期临床试验。目前该药物在美国仍处于I期临床阶段。
对此,有关注新冠药物的券商医药分析师对《科创板日报》记者分析,“新冠药物的研发肯定也要抢时间”。
同时,其认为由于国内防疫措施严格,新冠药物研发成功后更多的市场可能在海外。
另据《科创板日报》记者梳理,目前国内新冠肺炎药物的研发可谓“百花齐放”,主要以大分子的中和抗体和小分子药物为主,而小分子药物又有口服与注射剂之分,如前沿生物FB2001就属于后者。
而上述医药分析师又表示相对更看好小分子口服药的市场,“新冠口服药使用方便,可以大幅提高可及性。”
另有医药分析人士认为,小分子药物在价格和生产上更有优势,更具可及性和可负担性,“以大分子抗体药为例,其生产成本比小分子药物要高很多,需要依赖生物制药方法生成。”
在研进展方面,腾盛博药BRII-196&BRII-198本月已在国内获批,这是一款中和抗体组合;开拓药业的小分子口服药普克鲁胺处于全球III期阶段;真实生物的阿兹夫定处于全球III期阶段;君实生物的JS016已完成国际多中心Ⅱ期临床试验,正在积极推进Ⅲ期临床试验。
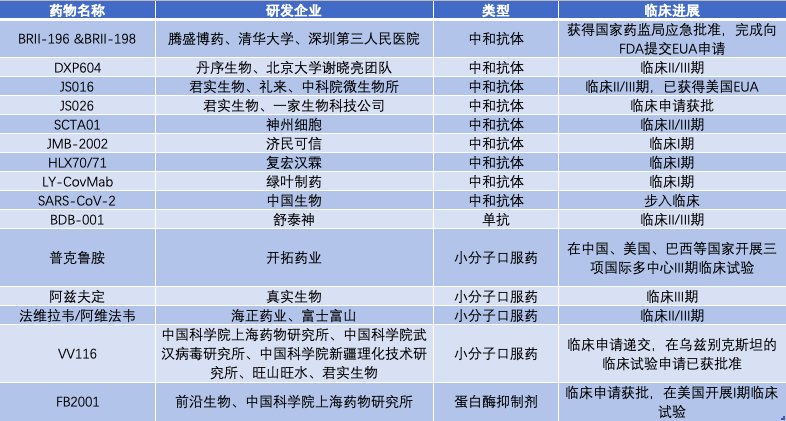
腾盛博药之后,国内新冠药物较受关注的是开拓药业在研的新一代雄激素受体拮抗剂普克鲁胺。该药前期在巴西开展的三项临床试验初步表明,普克鲁胺对新冠肺炎轻中症非住院和住院患者具有较好疗效,将重症患者死亡风险降低78%。
目前,普克鲁胺正在中国、美国、巴西等国家开展三项国际多中心III期临床试验,分别针对轻中症新冠患者和重症新冠患者,目前入组工作正在有序开展中。进展最快的是在美国等国家开展的针对轻中症新冠患者的III期临床试验,中期数据预计将在本月发布。
值得一提的是,普克鲁胺已经在巴拉圭获得紧急使用授权(EUA),用于新冠重症患者的治疗。
国内新冠小分子口服药领域,除了开拓药业的普克鲁胺,还有真实生物的阿兹夫定进展较快,该药物正在中国、巴西、俄罗斯开展III期临床试验。国内临床试验方面,已完成242例患者入组,正在协调增加郑州大学第一附属医院作为III期临床试验分中心,加速推进剩余患者入组,力争12月申请国内附条件批准上市。
文章来源:《临床药物治疗杂志》 网址: http://www.lcywzlzz.cn/zonghexinwen/2021/1214/1612.html